実行再生産数=1を目指すウィズ・コロナの真っ只中、また平井の豊田屋に鍋をつつきにいったときのメモです。しかも、一人で(友達いないボッチなので)。
-豊田屋 memo-
住所:江戸川区平井6-15-23-RATING- ★★★★★
-REVIEW-
酢の締め加減が穏やかで良い塩梅。ウェット過ぎず、パサつき過ぎずの絶妙のしっとり感。そのまま食べて凄く美味しいんだけど、お醤油をちょっと付けて食べると、甘みと脂が口の中いっぱいに広がり、まさに珠玉の味。
薬味は粉わさびね(いらない)。
-RATING- ★★★☆☆
-REVIEW-
本日のMメインディッシュ(鍋)。
具材は、鮪の赤身、葱、白菜、エノキ、糸こんにゃく、お豆腐、春菊。ねきまといいつつ、葱はあんまり入っていない。味付け(割下)はいつも通り極めて秀逸。
ふんだんに入っているメインの鮪は、微弱な野趣感を放ち食欲をそそり、身の繊維がホロホロと劈開していくような食感が心地いい。
-RATING- ★★★★☆
-REVIEW-
胡瓜と蕪の古漬は、生姜で香味付けされていて、いい感じに深みのある味わいに仕上がっています。
ところで、以前はカウンター席は予約できなかったと思ったんですが、最近は予約を入れるよいうになったみたいです。白子鍋、アンキモ鍋、アンコウ鍋、カキ鍋に食指が動く季節になってきましたが、身軽なお一人様でも予約入れないと厳しいかもです。
過去の豊田屋メモはこちら↓
閑話休題
凄く基本的なところですが、アミノ酸の分類(っていうほどでもないけど)のメモです。
ヒトのタンバク質の構成要素となっているアミノ酸は20種類あるわけで、それらの違いはα位から分岐した側鎖(side chain)にあり、側鎖の性質によって次の4つのグループに分類することができます。
(1) 脂肪族アミノ酸 (aliphatic amino acids)
プロリンは通常とは異なるαヘリックスを形成するようですが、これはプロリンが側鎖分子内で環状構造をとるため水素結合をつくることができないことに起因するようです。
またグリシンは、「側鎖=H」が小さすぎるので、αへリックスが形成されにくいといいます。
したがって、プロリンやグリシンがポリペプチド鎖内にあると、その部分で二次構造が作られなくなり、タンパク質分子の表面に出ることが多くなるのだとか。
(2) 非極性芳香族アミノ酸 (non-polar aromatic amino acids)
タンパク質分子において、非極性のアミノ酸が連なった領域は疎水性のコアを形成し、脂質などの非極性の構造と相互作用する一方、水や親水性の分子を遠ざけます(疎水性相互作用ですね)。
(3) 極性アミノ酸 (polar amino acids)
これらのアミノ酸は、タンパク質分子の親水性領域にみられ水存在環境で水和されます。
(a) アスパラギン酸:β-カルボキシル基のpKa = 3.7-4.0。
(b) グルタミン酸:pKa = 4.2-4.5。
ポリペプチドのC-末端のα-カルボキシル基(2.1-2.4)よりも幾分高い値となっており、それより高いpH領域ではイオン化されてカルボキシレートアニオンとなります。なので、生理的pH(7.5とか?)下でタンパク質の負電荷に寄与します。
化学修飾という観点からは、活性エステルを形成させることで、教科書的にエステル、チオセステル、アミド、ヒドラジン誘導体などへと誘導可能です。
他方、側鎖にイオン化可能なアミノ基を有するリシン、アルギニン、ヒスチジンは、タンパク質の正電荷に寄与します。
(c) リシン:側鎖のω-アミンはpKaが通常の一級アミンよりも僅かに高いです(9.3-9.5 for lysine vs. 7.6-8.0 for α-amines)。
(d) アルギニン:pKa > 12。強力な塩基性のグアジニノ基を側鎖に有する。イオン化点は高く、事実上常にプロトン化している。
(e) ヒスチジン:pKa = 6.7-7.1。側鎖にイミダゾール環。僅かに酸性サイドのpHでイオン化される。
リシン、アルギニン、ヒスチジンの側鎖のアミンは、通常タンパク質の表面にさらされ、容易に化学修飾されます。
(f) システイン
ヒトのタンバク質の構成要素となっているアミノ酸(二十種類)の中で唯一スルフヒドリル基(チオール)を有するアミノ酸がシステインです。生理的pHでは電荷を持たず、もっと高いpHでないとイオン化してチオレートアニオンにはななりません(pKa = 8.8-9.1)。
タンパク質分子中のシステイン残基の最も重要な反応は他のシステイン残基とのシステインジスルフィド(シスチン)の形成で、しばしばタンパク質の構造やコンフォーメーションの安定化のキーポイントになるといいます。システインやシスチンは比較的疎水性でタンパク質のコアによくみられます。
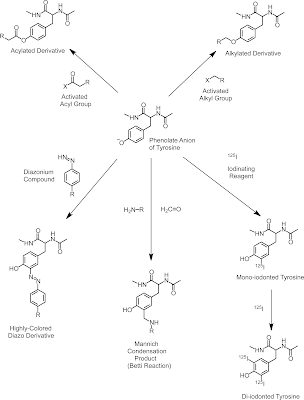
(g) チロシン
以上まとめますと、重要なアミノ酸=側鎖の反応性の高いアミノ酸は次に九つです↓
アスパラギン酸 (Asp)、グルタミン酸 (Glu)、リシン (Lys)、アルギニン (Arg)、システイン (Cys)、ヒスチジン (His)、チロシン (Tyr)、メチオニン (Met)、トリプトファン (Trp)です。
ボク的にはシステインのケミストリーに興味を掻き立てられますね。一般論としてチオールって積極的に扱わないじゃないですか。理由は相当にくさいから。でも、システインは粉物(240℃でdecomp.)なので許容範囲の匂いでしょ。なので、システイン(誘導体)を使って、チオールのケミストリーを修行してみたい気分です。
余談だけど、ハイミー(パッパッパ♪)って味の素よりも「うま味」の強い調味料だって知ってた?
以上、国内二流大出のテクニシャン(研究補助員)の天然アミノ酸基礎的分類メモでした。











0 件のコメント:
コメントを投稿